▌ 导语:
在国庆长假前夕,美国FDA传来喜讯。FDA宣布批准礼来(Eli Lilly)公司的Verzenio(abemaciclib)上市,与fulvestrant联用治疗HR阳性、HER2阴性的晚期或转移性乳腺癌成人患者。这些患者先前曾接受内分泌疗法,但病情依旧出现进展。

FDA也批准Verzenio单独使用,治疗接受过内分泌疗法与化疗,癌症却出现转移的同一患者群体。本款新药的获批上市,将为诸多患者带来全新希望。
乳腺癌是美国最常见的癌症,根据美国国家癌症研究所(NCI)统计,今年大约有25万名女性将被新诊断出乳腺癌,并有约40000人死于这项疾病。在这些患者中,HR阳性、HER2阴性的患者占到了72%。为这些患者带来全新治疗方案,能为乳腺癌的治疗格局带来很大改观。
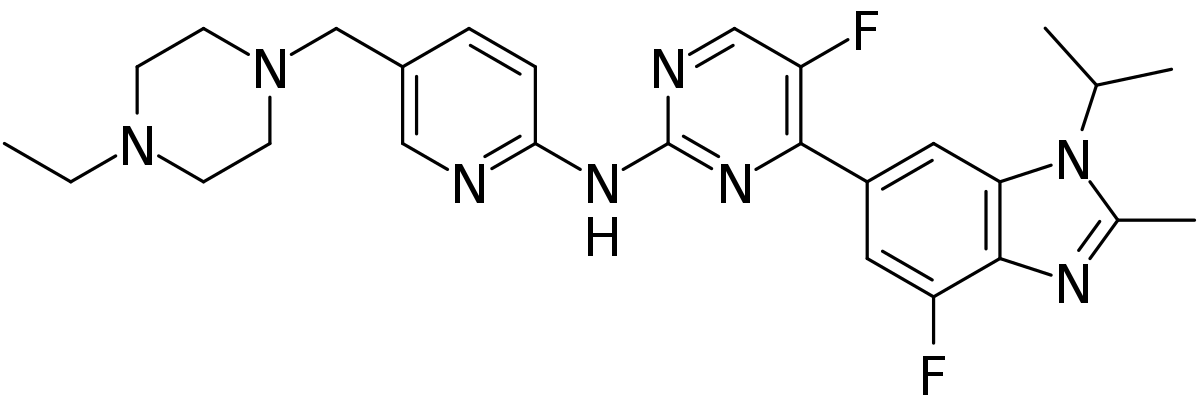
▲Abemaciclib的分子结构式
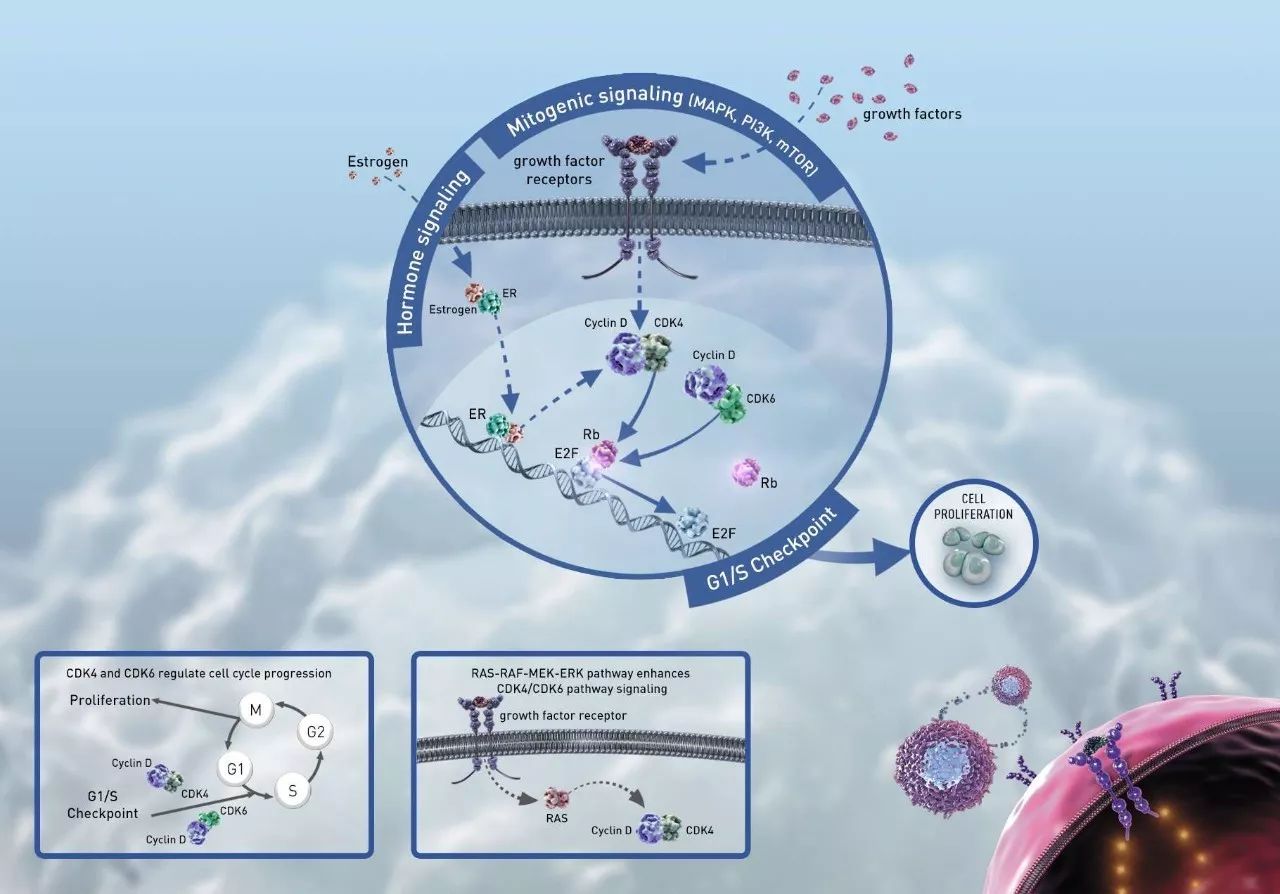
▲Abemaciclib的作用机理
在一项临床试验中,Verzenio的安全性与疗效得到了验证。这项试验招募了669名患者,她们均患有HR阳性、HER2阴性的乳腺癌,且在内分泌疗法的治疗后,疾病依旧出现了进展。这项研究发现,接受Verzenio与fulvestrant治疗的患者,其中位无进展生存期(PFS)为16.4个月,高于使用安慰剂与fulvestrant的患者(9.3个月)。
此外,作为单独疗法,Verzenio的安全性与疗效在一项有132名患者参与的临床试验中接受了检验。这些HR阳性、HER2阴性的患者在内分泌疗法与化疗的治疗后,癌症依旧发生进展。在Verzenio的治疗后,有19.7%的患者出现了完全缓解(CR)或部分缓解(PR),中位客观缓解时间为8.6个月。
无论是作为联合疗法,还是单独疗法,Verzenio的安全性都获得了认可。因此,美国FDA也于今日批准它上市,早日为患者带来福音。值得一提的是,这是美国FDA批准的第三款CDK4/6抑制剂,也是唯一一款获批作为单独疗法使用的CDK4/6抑制剂。
“Verzenio为特定的乳腺癌患者带来了全新的靶向治疗方案。这些患者对目前的治疗没有响应。与该类别的其他新药不同,这款新药能作为单独疗法,治疗这些接受过内分泌疗法和化疗的患者。”美国FDA肿瘤学卓越中心主任兼FDA药物评估与研究中心血液学和肿瘤学产品办公室主任Richard Pazdur博士评论道。
我们祝贺礼来喜迎新药获批上市,也祝愿好药新药能层出不穷,延长患者的生命。
参考资料:
[1] FDA approves new treatment for certain advanced or metastatic breast cancers
[2] 礼来官方网站
▌ 推荐阅读:
转移后的肿瘤与原发肿瘤有何区别
治疗特定前列腺癌,首款新药有望近期上市!



