▌ 导语:
40年来,FDA加速批准的首个软组织肉瘤一线药物Lartruvo(olaratumab)都显得有些星光黯淡了。主要对手太凶残,比如默沙东的PD-1抗体Keytruda弯道超车成为肺癌一线用药,转身BMS的Opdivo就拿下了头颈鳞癌的适应症,这不罗氏的PD-L1抗体也获批了非小细胞肺癌的二线治疗。PD-1抗体的厮杀已经足够凶残,华西魔剪也要在PD-1插一脚,还有乱入的胰腺癌孤儿药……
肉瘤。软组织肉瘤(STS)是对发生于全身软组织(脂肪、肌肉、神经、纤维组织、血管)的一大类恶性肿瘤的统称,非常复杂并具有多种亚型,使得难以诊断和治疗。近几十年来,能够延长晚期软组织肉瘤总生存期(OS)的一线治疗方面始终无进展。因此,该领域的医疗需求远未得到满足。这样看来,Lartruvo真的是肉瘤界超新星啊~~~
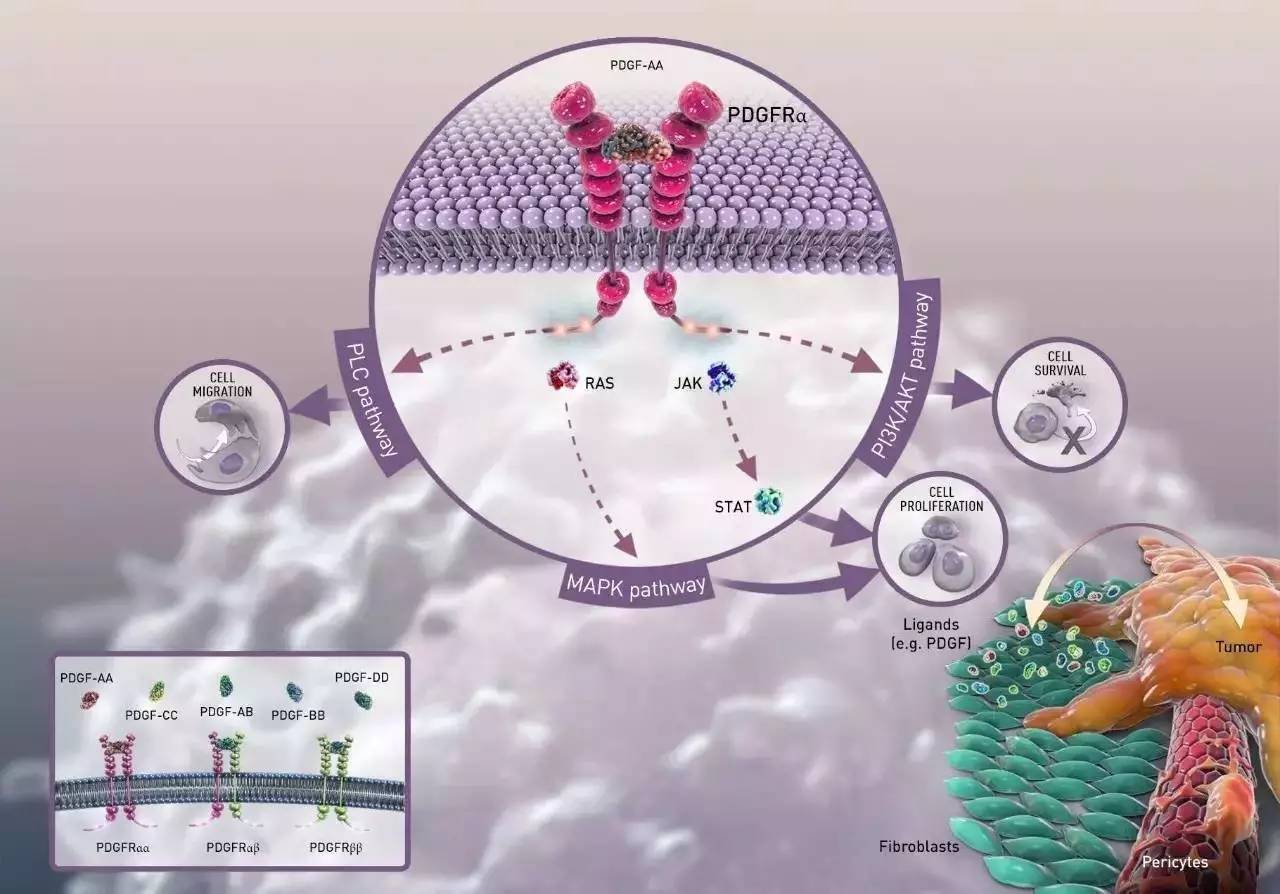
Lartruvo的光环不仅仅是“孤儿药”赋予的,自己也是相当拿得出手滴。Lartruvo是血小板衍生生长因子受体-α(PDGFα)的阻截型抗体。PDGFα激活后,下游信号通路可引起肿瘤生长。于是,Lartruvo通过阻断这些受体来有效减缓或终止肿瘤生长,细节如下:
Lartruvo的获批,是基于一项关键性II期JGDG研究的数据。该研究是一项开放标签、随机的研究,在133例组织学亚型为适合含蒽环类方案并且不适合采用放疗或手术根治的软组织肉瘤成人患者中开展,测量了治疗后患者存活时间(总生存期,OS),治疗后肿瘤无进展时间(无进展生存期, PFS)以及客观有效率(总反应率,ORR),将Lartruvo+阿霉素(多柔比星,Doxorubicin)联合用药与阿霉素单药化疗的数据进行了对比:
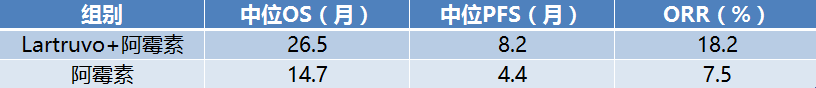
数据显示:与阿霉素单药组相比,联合组中位OS提高11.8个月,中位PFS也显著提高3.8个月,基本都是提升了一倍啊!
更为直观OS的可以看图,看看上面联合组那条拖尾的直线:
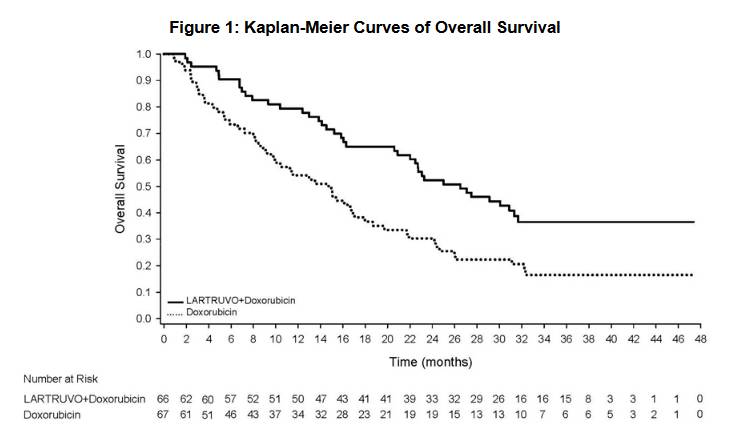
在安全性方面,联合组死亡39例(59%),单药组死亡52例(78%)。期间,Lartruvo也有输注不良反应、治疗相关不良反应和胚胎毒性。输注不良反应包括低血压、发热、恶寒及皮疹,治疗相关不良反应包括恶心、疲劳、轻度中性粒细胞减少症、肌肉骨骼痛、黏膜炎、脱发、呕吐、腹泻、食欲不振、腹痛、神经损害及头痛。
基于这项实验,Lartruvo也速度获得了欧盟的有条件上市批准,效率杠杠的。Lartruvo作为首个赢得欧盟批准用于软组织肉瘤的单抗药物,可与阿霉素联合用于晚期软组织肉瘤,适用于手术或放疗不适合的患者。
目前,Lartruvo联合阿霉素化疗治疗晚期软组织肉瘤的一项III期临床已完成患者招募。礼来将根据该项III期研究的数据,将FDA加速批准和欧盟有条件批准转变为完全批准。
补充一下,今年1月,FDA批准日本药企卫材(Eisai)研发的新型抗癌药Halaven(甲磺酸艾日布林)治疗晚期或转移性脂肪肉瘤。今年5月,Halaven再获欧盟批准治疗不可切除性脂肪肉瘤,这是软组织肉瘤的一种亚型。
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。