▌ 导语:
今天,SillaJen公司和李氏大药厂(Lee's Pharmaceutical)宣布,国家食品药品监督管理总局(CFDA)批准了一项用在研药物Pexa-Vec(先前名为JX-594)治疗晚期肝癌的3期临床试验PHOCUS。

肝癌也称为肝细胞癌(HCC),是一种源自肝部的癌症(并非是源自其他器官进而转移至肝脏的癌症)。索拉非尼(Nexavar®,sorafenib)是目前唯一被批准用于治疗晚期肝癌的全身性(systemic treatment)药物。
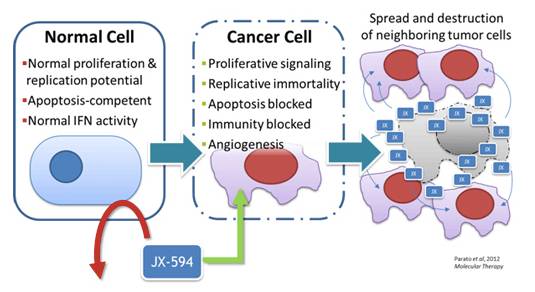
Pexa-Vec是SillaJen专有的SOLVE平台中最先进的候选药物。Pexa-Vec牛痘菌株骨架曾做为全球接种计划的一部分在数百万人中安全使用。这一菌株由于癌细胞中常见的遗传缺陷可以自然靶向癌细胞。Pexa-Vec可以通过删除其胸苷激酶(TK)基因来增强这一功能,使其依赖于在癌细胞中持续高水平表达的细胞TK。Pexa-Vec也用于表达免疫原性GM-CSF蛋白。这一蛋白互补了候选药物的癌细胞裂解,导致肿瘤坏死、肿瘤血管系统停止和持续的抗肿瘤免疫攻击等事件。
▲Pexa-Vec的作用机理(图片来源:SillaJen官网)
关于该药物治疗晚期肝癌的PHOCUS是一项国际3期临床研究,招募从未接受过针对晚期肝癌的全身性药物治疗的患者。这些患者将被随机分配到两个治疗组,一组接受Pexa-Vec和索拉非尼治疗,另一组只接受索拉非尼治疗。研究的主要目的是比较这两组患者的总体生存期(OS),以确定该药物是否可以减缓晚期肝癌的进展速度,同时提高生活质量。
“这是一个令人兴奋的进步,也是Pexa-Vec计划的一个重要里程碑,”SillaJen的首席执行官Eun Sang Moon博士说道:“我们深切地意识到中国肝癌有许多未被满足的需求,我们衷心希望未来几年可以为这些患者提供Pexa-Vec。”
“我们很高兴CFDA的药品审评中心能批准3期临床试验的申请。我们期待PHOCUS试验在中国进行。这是Pexa-Vec开发的一个重要里程碑,也是我们与SillaJen团队合作的结果,”李氏大药厂的首席执行官Benjamin Li博士说。
参考资料:
[1] SillaJen And Lee's Pharmaceutical Announce Approval By The China CFDA To Commence Phase III Clinical Trial For Oncolytic Immunotherapy, Pexa-Vec, In Liver Cancer
[2] 关于 PHOCUS 试验
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。