


▌ 导语:
Medivir AB近日公布了一项2期临床试验的有效性和安全性数据,研究显示每日两次局部使用含1%的remetinostat凝胶治疗蕈样真菌病(Mycosis Fungoides,MF)型早期皮肤T细胞淋巴瘤(CTCL),可以减轻患者的皮肤损伤。此外,由此病引起的患者瘙痒的也得到了显著改善。

皮肤T细胞淋巴瘤是一种罕见慢性血液癌症,主要症状呈现在皮肤组织上。根据美国国家癌症研究所(National Cancer Institute),最常见的CTCL是MF变体形式。在美国,MF影响约2万病人,每年估计有1500例新增病例,其中约75%具有早期疾病症状。患者往往长期处于此阶段,并且需要针对该疾病进行长期的局部性治疗,这一漫长治疗措施也大大降低了患者的生活质量。一小部分患者继续发展成为皮肤肿瘤或全身性疾病,此时他们便需要全身性抗癌治疗。
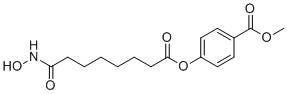
▲Remetinostat分子结构式
本研究的主要终点是使用损害严重程度综合评价指标,评估患者对治疗有完全或部分缓解的比例。这项研究的剂量反应显示,接受最高剂量的第三组患者缓解最多,达40%(8/20),包括1例完全缓解。第一组和第二组的缓解率分别为25%(5/20)和20%(4/20)。研究次要终点使用视觉模拟量表(VAS),对研究期间内每月瘙痒症状的治疗效果进行评估。在有严重的瘙痒患者中,第三组患者降低瘙痒的比例最多,达80%。第一组和第二组患者的瘙痒减少分别为50%和37.5%。瘙痒减少的定义为在超过 4周期间内,根据VAS评分,从基线起至少有30毫米的减少。

▲Medivir AB的首席医学官John Öhd博士
参考资料:
[1] Medivir (MVRBF) Release: Remetinostat Phase II Data Demonstrate Efficacy On Skin Lesions, Reduction Of Itching And High Tolerability In Patients With Early-Stage MF-Type CTCL
[2] Remetinostat phase II data demonstrate efficacy on skin lesions, reduction of itching and high tolerability in patients with early-stage MF-type CTCL
▌ 推荐阅读:
延长总生存期!肝癌新药3期临床结果出色
抗流感病毒新药获美国FDA突破性疗法认定