


▌ 导语:
Ansun BioPharma今日宣布,FDA为Ansun的同类首款(first-in-class)在研药物DAS181颁发了突破性疗法认定,用于治疗免疫缺陷患者由副流感病毒(PIV)引起的下呼吸道感染。PIV感染导致免疫缺陷患者和住院病人高发病率和死亡率,而目前还没有治疗PIV感染的方法。

DAS181的分子模型,绿色为唾液酸酶催化区域,蓝色为C端的锚定区域
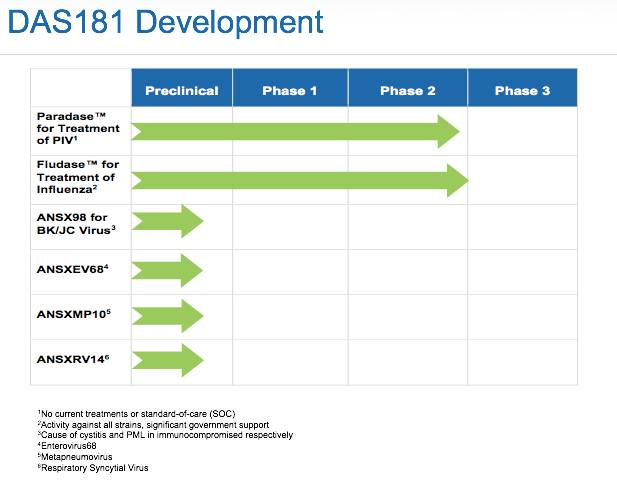
Ansun的多项在研新药
Ansun Biopharma的首席执行官Nancy Chang博士表示: “我们已经研发了DAS181许多年,以治疗PIV感染重症患者和患有包括流感在内的其他呼吸道传染病患者。FDA授予的突破性疗法认定,对临床开发潜在拯救生命的药物来说,是一个重要的里程碑。”
我们衷心期待这款药物在接下来的3期临床试验能够顺利进行,早日为患有此类病毒感染的患者带来首款药物!
[1] San Diego Ansun BioPharma's Drug Bestowed With Breakthrough Tag
[2] Ansun BioPharma Announces Breakthrough Designation for its Experimental Drug DAS181
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。
▌ 推荐阅读:
解密:肿瘤界的“伪装者”表现极不起眼!
罕见病,有钱想治却无药可医!——进行性肌营养不良症