▌ 导语:
今日,诺华公司宣布,美国FDA授予其Tafinlar+Mekinist组合突破性疗法认定,用于具有BRAF V600突变的III期黑色素瘤患者完全切除手术后的辅助治疗。如果获批,它将成为针对这一患者群体的首个辅助治疗。

全世界每年约有20万例新诊断的黑色素瘤病例,其中约一半具有BRAF突变,可以通过基因检测确定。接受黑素瘤手术治疗的患者可能具有较高的复发风险,因为黑素瘤细胞可以在手术后留在体内。所以对高风险的黑素瘤患者进行辅助治疗非常必要,以降低黑素瘤复发的风险。
Tafinlar+Mekinist组合疗法就具有这样的潜力。Tafinlar和Mekinist分别针对RAS/RAF/MEK/ERK通路中丝氨酸/苏氨酸激酶家族中的不同激酶——BRAF和MEK1/2,它们常见于非小细胞肺癌(NSCLC)和黑素瘤等癌症。当Tafinlar与Mekinist一起使用时,可以比单独使用更有效地减缓肿瘤生长。目前,这一组合的疗效正在多种肿瘤类型的临床试验中进行评估。
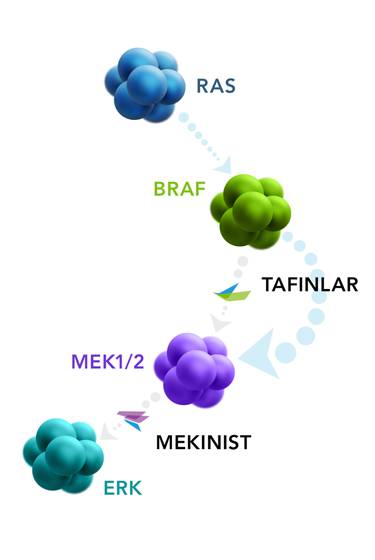
此次,FDA对该疗法颁发的突破性疗法认定是基于一项3期临床试验COMBI-AD的数据。该试验包含870名具有BRAF V600E/K阳性突变的III期黑色素瘤患者,他们在完全切除手术后接受Tafinlar(150 mg BID)+Mekinist(2 mg QD)组合疗法(n=438)或安慰剂治疗(n=432)。主要终点为无复发生存期(RFS),次要终点为总生存期(OS)、无远处转移生存期(DMFS)、免于复发率(FFR)和安全性。
经过中位数2.8年的随访期,试验抵达了主要研究终点。与安慰剂相比,Tafinlar+Mekinist组合疗法将疾病复发或死亡风险降低了53%(HR: 0.47 [95% CI: 0.39-0.58]; 16.6个月vs. 中位数未达到; p<0.001)。RFS益处在所有患者亚组中观察到,包括IIIA、B和C期。不良事件(AEs)与其它Tafinlar + Mekinist研究一致,没有发现新的安全问题。这一结果公布在近期举行的欧洲肿瘤内科学会(ESMO)大会上,并发表在《New England Journal of Medicine》上。
“手术切除后具有高复发风险的III期黑素瘤患者需要更有效的治疗方案,”诺华肿瘤部执行副总裁兼全球药物开发部负责人Samit Hirawat博士在一份声明中说:“我们感谢FDA认可Tafinlar和Mekinist在这种辅助治疗中提供的科学进步。”
我们期待这一充满潜力的组合疗法也可以顺利获批用于这一新的适应症,为这些黑色瘤患者群体带来疾病缓解。
参考资料:
[1] FDA Calls Novartis' Melanoma Combo Drug a Breakthrough
[2] Novartis官网
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。
▌ 推荐阅读:
1、PC链接 ▪ 手机连接
坦帕诺(tenapanor)治疗肠易激综合症便秘!
2、PC链接 ▪ 手机连接
FDA批准:第一项治疗白血病的基因疗法!
3、PC链接 ▪ 手机连接
延长总生存期!肝癌新药3期临床结果出色




