▌ 导语:
今日,美国FDA传来重磅消息——拜耳(Bayer)药物Stivarga(regorafenib)获批扩大适应症,治疗那些已使用过肝癌药物sorafenib进行治疗,但疾病依旧出现进展的肝细胞癌患者。值得一提的是,这是美国FDA在近10年来批准的首款肝癌药物。


▲Regorafenib的结构式(图片来源:New Drug Approvals)
由拜耳带来的regorafenib是一款激酶抑制剂,能抑制促进肿瘤生长的多种酶,其中包括了那些参与血管内皮生长因子通路的酶。先前,regorafenib已获批治疗那些对现有疗法治疗无响应的结直肠癌或胃肠道间质瘤患者。
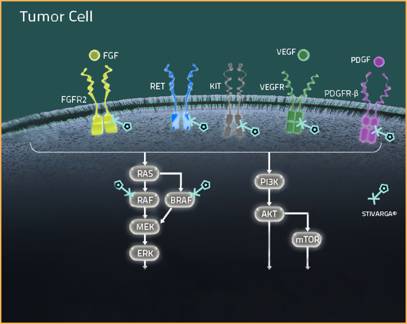
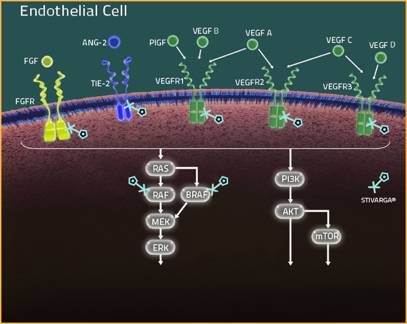
▲Regorafenib能抑制多种酶(图片来源:Stivarga-us.com)
在一项检验regorafenib治疗肝细胞癌潜力的临床试验中,研究人员招募了573名在接受sorafenib治疗后病情仍出现进展的肝细胞癌患者,并评估了这些患者在治疗后的总生存期(OS)、无进展生存期(PFS)与总体缓解率(ORR)。研究发现,接受regorafenib治疗的患者中位数总生存期为10.6个月,中位数无进展生存期为3.1个月,而对照组的数据分别为7.8个月(OS)和1.5个月(PFS)。在总体缓解率上,接受regorafenib治疗的患者达到了11%,接受安慰剂的对照组数据为4%。今年1月,regorafenib获得了二线治疗肝癌的优先审评资格。今日,基于这些出色的数据,regorafenib得到了FDA的批准,将适应症扩大到了肝癌的治疗。
“对肝癌患者来说,他们能用上的治疗方案非常有限,”FDA肿瘤卓越中心(Oncology Center of Excellence)主任兼FDA药物评估与研究中心血液学与肿瘤产品办公室主任Richard Pazdur博士说:“这是FDA批准的首款能在sorafenib初始治疗停止响应后,继续治疗肝细胞癌患者的疗法。”
我们祝贺拜耳取得的成绩,并祝愿更多的肝癌药物能够获批上市,治疗这一顽疾。
参考资料:
[1] FDA expands approved use of Stivarga to treat liver cancer
[2] FDA Grants Bayer Priority Review for Stivarga® (regorafenib) for the Second-Line Systemic Treatment of Liver Cancer
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。



