▌ 导语
据大通福克斯美国会诊中心(CMAA)了解:近期,Kyowa Hakko Kirin公司宣布美国FDA已经接受mogamulizumab的生物制剂许可申请(BLA),用于治疗曾接受过至少一种系统治疗的皮肤T细胞淋巴瘤(CTCL)患者,并授予其优先审评资格。相关最新的资讯信息,大通福克斯美国会诊中心(CMAA)将持续为您报道。
Kyowa Hakko利用其专有的POTELLIGENT®平台研发的mogamulizumab是一款针对CC趋化因子受体4(CCR4)的人源化单克隆抗体(mAb),CCR4经常在某些恶性血液肿瘤(包括CTCL)的白血病细胞上表达。Mogamulizumab于2012年在日本首次被批准用于治疗其它恶性血液肿瘤,并于2014年被批准用于治疗CTCL。美国FDA已经授予mogamulizumab突破性疗法认定,用于治疗至少接受过一种系统治疗的MF和SS患者。此次mogamulizumab再次获得优先审评资格,证明它在治疗CTCL方面的潜力。
Mogamulizumab的疗效在一项3期临床试验MAVORIC中得到验证。这项开放标签、多中心、随机试验评估了mogamulizumab在使用过至少一种系统治疗后失败的MF和SS患者中的疗效,它在美国、欧洲、日本和澳大利亚共招募了372名患者。顶线结果证明,使用mogamulizumab治疗的患者的无进展生存期(PFS)相比对照组有显著改善,同时耐受性良好。
[1] Kyowa Hakko Kirin Announces FDA Acceptance for Filing and Priority Review Designation of Mogamulizumab's Biologics License Application
据大通福克斯美国会诊中心(CMAA)了解:近期,Kyowa Hakko Kirin公司宣布美国FDA已经接受mogamulizumab的生物制剂许可申请(BLA),用于治疗曾接受过至少一种系统治疗的皮肤T细胞淋巴瘤(CTCL)患者,并授予其优先审评资格。相关最新的资讯信息,大通福克斯美国会诊中心(CMAA)将持续为您报道。
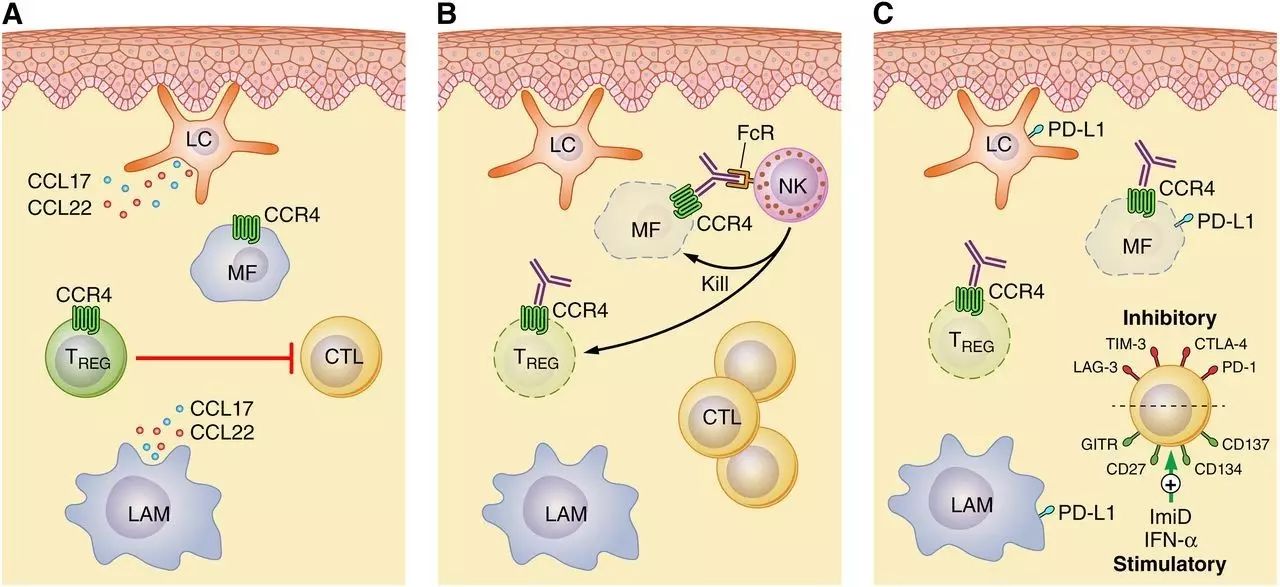
▲CCR4是皮肤T细胞淋巴瘤的治疗靶点
CTCL是一种罕见的非霍奇金T细胞淋巴瘤,两种最常见的CTCL类型是蕈样真菌病(MF)和Sezary综合征(SS)。根据阶段,这种疾病可能涉及皮肤、血液、淋巴结和内脏。晚期阶段的CTCL更是与显著的发病率和死亡率有关。这些患者急需新的治疗方案来缓解疾病。
Kyowa Hakko利用其专有的POTELLIGENT®平台研发的mogamulizumab是一款针对CC趋化因子受体4(CCR4)的人源化单克隆抗体(mAb),CCR4经常在某些恶性血液肿瘤(包括CTCL)的白血病细胞上表达。Mogamulizumab于2012年在日本首次被批准用于治疗其它恶性血液肿瘤,并于2014年被批准用于治疗CTCL。美国FDA已经授予mogamulizumab突破性疗法认定,用于治疗至少接受过一种系统治疗的MF和SS患者。此次mogamulizumab再次获得优先审评资格,证明它在治疗CTCL方面的潜力。
Mogamulizumab的疗效在一项3期临床试验MAVORIC中得到验证。这项开放标签、多中心、随机试验评估了mogamulizumab在使用过至少一种系统治疗后失败的MF和SS患者中的疗效,它在美国、欧洲、日本和澳大利亚共招募了372名患者。顶线结果证明,使用mogamulizumab治疗的患者的无进展生存期(PFS)相比对照组有显著改善,同时耐受性良好。
“我很高兴FDA接受了mogamulizumab的BLA并授予优先审评资格,这是我们的子公司Kyowa Kirin Pharmaceutical Development的另一个重大成就,”Kyowa Hakko Kirin研发部副总裁兼执行官Mitsuo Satoh博士说:“我们将继续与FDA等监管机构合作,尽快向美国的CTCL患者提供该药物。”
[1] Kyowa Hakko Kirin Announces FDA Acceptance for Filing and Priority Review Designation of Mogamulizumab's Biologics License Application
[2] Kyowa Hakko Kirin官方网站
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。
▌ 推荐阅读
CMAA报道 | 美国FDA批准治疗哮喘的新药上市了



