▌ 针对病毒相关DNA的液体活检对筛查鼻咽癌的效果良好
一项由著名华人学者卢煜明教授领导的包含有两万多名患者并随访三年的研究表明,鼻咽癌可以被液体活检技术探测到并采取治疗。这种生长于喉咙里的癌症在中国华南地区非常普遍。论文发表在8月的《New England Journal of Medicine》上。
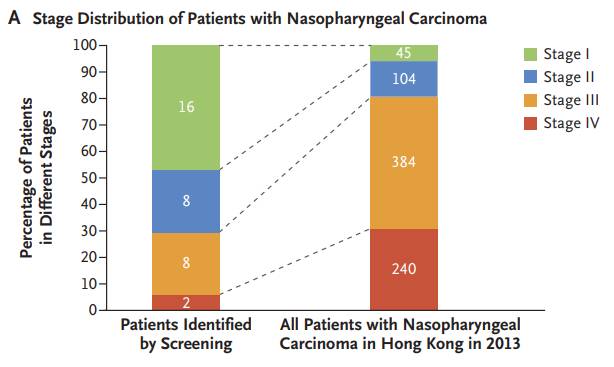
循环型无细胞EB病毒(Circulating cell-free Epstein–Barr virus,EBV)的DNA是鼻咽癌的生物标志。卢煜明教授的团队调查了能否用血液样本中的EBV DNA来筛查尚无症状人群的早期鼻咽癌的存在与否。他们分析了血浆标本中的EBV DNA,初次结果呈阳性的参与者会在大约四周后再次接受检测,而在再次血浆测试中EBV DNA持续呈阳性的患者则会接受鼻内窥镜的检查和磁共振成像(MRI)的检查。一共有20,174人参加了筛选,初次检查在5.5%的人的血浆样本中检测到EBV DNA,在四周后的重复检查中持续呈阳性的有309人,占所有参与者的1.5%,以及初筛阳性者的27.8%。这些持续阳性的参与者大部分接受了内窥镜检查,或者内窥镜与MRI的复合检查。结果发现,这些参与者中有34人患有鼻咽癌。
▲与历史数据(右)相比,早筛找到的患者群体,疾病明显处于早期(图片来源:《NEJM》)
通过筛查确定的1期和2期鼻咽癌患者比例高于历史记录(71%对20%),3年的无进展生存率也较好。在检测后1年内,只有1名血浆EBV DNA筛选呈阴性的患者出现了鼻咽癌。 EBV DNA在鼻咽癌筛查中的敏感性和特异性分别为97.1%和98.6%。这结果说明,对于血浆样本中EBV DNA的分析可用于早期无症状鼻咽癌的筛选。
▌ Kite Pharma针对多发性骨髓瘤的药物即将开始临床1期实验
据Kite Pharma宣布,美国FDA已经批准了其CAR-T疗法KITE-585的IND申请。这款疗法将于近期启动1期临床试验。KITE-585计划用于治疗复发和难治性多发性骨髓瘤(Multiple Myeloma),那是种病发于骨髓浆细胞的癌症。异常的浆细胞会不受控制地增长,抑制骨髓其他细胞的诞生。在2017年,全美估计有30280个新发多发性骨髓瘤的病例,并会有12590名患者因为这个疾病而去世。这种疾病的预后一般,经诊断后的5年生存率约为50%。
KITE-585是一款针对BCMA的药物。在大部分多发性骨髓瘤患者的恶性浆细胞表面都表达BCMA蛋白。它也出现在正常浆细胞上和特定的成熟B细胞上,但其他组织不会表达这种蛋白。KITE-585含有从全人源单克隆抗体上衍生出的受体,并带有CD28共刺激域,对CAR-T疗法有所优化。在临床前试验中,无论靶点表达的BCMA浓度是高是低,KITE-585都显示出了结合的活性。而且,它的活性不会受到可溶BCMA蛋白水平的影响。
“KITE-585有潜力成为Kite在细胞疗法领域的下一个重要进展。我们做了大量的临床前开发工作,这包括候选物筛选、工程化、以及测试。我们的内部研究团队做了许多工作,这也反映了Kite在CAR设计和细胞疗法领域的丰富经验,”Kite研发执行副总裁兼首席医学官Davie Chang博士说道。
▌ CRISPR-Cas9技术筛选出与免疫疗法相关的重要基因
由美国多家研究所合作,包括Broad Institute的张锋博士在内,近日在《自然》上发表了通过CRISPR-Cas9技术筛选与癌症免疫疗法效果相关基因的论文。
体细胞基因突变,能影响癌细胞对于基于T细胞的免疫疗法的敏感度。在文中,研究者们使用了含有约123,000个sgRNA,规模覆盖全基因组的CRISPR-Cas9文库,扰乱了人类黑素瘤细胞中的基因,并且分析了哪些基因在被CRISPR-Cas9编辑失去功能后,会影响CD8 + T细胞的效应功能。
▲过量表达APLNR,让肿瘤细胞溶解的更多(图片来源:《自然》)
研究者发现,经过这种筛选得到富集的基因在抗原呈递和干扰素-γ信号传导中具有关键作用,并且与癌症基因组图谱(Cancer Genome Atlas)的患者肿瘤中的溶细胞活性相关。研究者采用了不同癌细胞系和抗原验证,最后鉴定出在免疫治疗难治性的患者肿瘤中,编码apelin受体的APLNR有多种功能失活性的突变。研究者显示了APLNR能与JAK1相互作用,调节肿瘤中的干扰素γ反应,它的失活能降低小鼠模型中过继免疫细胞疗法(adoptive cell transfer)和检查点阻断免疫疗法(checkpoint blockade immunotherapies)的功效。这篇论文把对癌症免疫治疗的抗性或无反应,与CD8 + T细胞的效应功能的必需基因的功能损失联系起来,推进了对免疫疗法的理解。
▌ Avelas Biosciences的手术标记物AVB-620开始在乳腺癌患者中进行2期临床试验
Avelas Biosciences公司近日宣布,在AVB-620的2期临床试验中,他们已经给予原发性,非复发,正在接受手术的乳腺癌患者使用药物了。
该公司总裁兼首席执行官Carmine Stengone先生表示:“我们很高兴能开始AVB-620的2期临床试验,给在接受手术治疗的乳腺癌妇女用药,这是Avelas的一个重要里程碑。这项试验将能让我们确认临床1b期试验的结果,也即AVB-620可以产生可以能区分乳腺癌组织和相邻正常组织的荧光信号,我们很期待能把这重要信息提供给正在做手术的外科医生参考。”而Avelas Biosciences的首席医学官Steven Chen博士表示:“像AVB-620这样的手术标记可以让外科医生在手术时可视化癌症,并据此做出明智的实时决定,来提升癌症手术治疗的效果。这种技术有可能减少由于初次手术时切除不完全而所需的再次手术的次数,因此节省大量成本,并为患者带来更好的结果。”
AVB-620的临床2期研究是开放标签,单臂的实验,旨在评估在两个试验时期内的100名患者。第1期将有约30名患者进行测试,以实现恶性和非恶性组织之间的荧光信号的最大差异。第2期将评估大约70名患者,测试在第1期里确定的剂量和成像条件,以及在区分恶性和非恶性组织方面AVB-620成像数据的准确性。
▌ Kite的突破性CAR-T疗法有望近期获批
在第二季度的总结报告中,Kite的研发执行副总裁兼首席医学官David Chang博士透露,美国FDA已经通知Kite,不会为其突破性CAR-T疗法axicabtagene ciloleucel(下称axi-cel)进行外部专家的小组审评。考虑到FDA刚刚完成对这款疗法生产基地和治疗中心的检查,业内诸多资深分析师认为,不召开小组审评的决定,表明FDA对这款疗法的生产和治疗流程表示满意,没有额外担忧。一些分析师乐观地估计,这款疗法会比预期提前获批上市。而Kite也已经做好了准备。Kite的高层提到,在9月份,Kite的CAR-T疗法生产与运输的工作就有望完全就绪,进入随时待命的状态。只要FDA亮绿灯,他们就能为患者第一时间送上这款重磅疗法。
由Kite带来的axi-cel是一款领先的CAR-T疗法。它从患者体内分离出T细胞,并使用工程化的手段,让这些细胞表达靶向CD19抗原的嵌合抗原受体(CAR)。这些CAR会引导T细胞进攻B细胞淋巴瘤和白血病细胞,并对癌细胞进行杀伤。先前,axi-cel曾获得FDA颁发的突破性疗法认定,治疗弥漫性大B细胞淋巴瘤(DLBCL)、转化滤泡性淋巴瘤(TFL)、以及原发性纵隔B细胞淋巴瘤(PMBCL)这三种非霍奇金淋巴瘤。今年5月,它也获得了FDA颁发的优先审评资格,答复截止日期为今年的11月29日。
在CAR-T疗法领域取得的出色进展,让Kite公司看到了为患者带来更多疗法的希望。Kite的首席执行官Arie Belldegrun博士说:“2017年剩下的日子里可预见的一些事件,表明了CAR-T疗法的潜力。对于特定的癌症患者来说,它有望成为最强力的抗癌疗法之一。离这一天的到来,也许已经不远了。”
参考资料:
[1] Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer
[2] Kite Pharma (KITE) files key FDA filing for KITE-585
[3] Identification of essential genes for cancer immunotherapy
[4] Avelas biosciences doses first patient in Phase II study of AVB-620 in women with primary, nonrecurrent breast cancer undergoing surgery
[5] Prepping for a rapid-fire launch, Kite Pharma gets a pass from FDA on axi-cel panel review
▌ 推荐阅读:
1、PC链接 ● 手机连接
速递 | 喜获优先审评,Gilead艾滋病新药有望加快上市
2、PC链接 ● 手机连接
首个黑色素瘤靶向新药在中国上市,提高患者客观缓解率近7倍
3、PC链接● 手机连接
40年来化疗新突破!美国FDA今日批准白血病新药