▌ 导语:
Patisiran利用身体的天然机制,降低引起TTR淀粉样变的TTR蛋白的水平。它可以靶向和沉默特定信使RNA,阻碍TTR蛋白生成。可有助于清除周围组织的TTR淀粉样蛋白沉积,并恢复这些组织的功能。
APOLLO 是一项随机,双盲,安慰剂对照的全球性3期临床试验,旨在评估patisiran在多发性神经病变的hATTR淀粉样变患者中的疗效和安全性。这项研究的主要终点是在18个月期间内,225名患者修正神经病变损害评分(mNIS+7)从基线的变化。在18个月期间内,与安慰剂组相比,mNIS+7从基线明显降低(p小于0.00001),生活质量明显改善(p小于0.00001)。Patisiran治疗组与安慰剂组相比,mNIS+7损伤评分和生命质量评分的平均值和中位数变化均达到负值,说明在大部分患者和总体患者中都得到改善。5个其他次要终点与安慰剂相比还显示了显著的差异(p小于0.001)。Patisiran的总体安全性良好。Patisiran组和安慰剂组有类似比例的不良事件(AEs)(分别为96.6%和97.4%)和严重不良事件(SAEs)(分别为36.5%和40.3%)。
Alnylam已经启动了patisiran的滚动新药申请(NDA),并预计在2017年底进行最后一次提交。Patisiran已在美国获得了快速通道认定,并在最近获得了欧洲药品管理局的加速评估。Alnylam与Sanofi Genzyme结盟,计划年底前在欧盟提交营销授权申请。
“hATTR淀粉样变性是一种侵袭性,进展迅速,使人衰弱的致命疾病,对治疗方案的需求迫在眉睫。APOLLO 3期临床研究的有力证据表明,在研patisiran疗法有潜力改变hATTR淀粉样变性患者的生命,”TTR项目副总裁兼总经理Eric Green先生说:“突破性疗法认定使我们能够与FDA密切合作审查新药申请,尽快为患有这种令人痛苦的疾病患者带来patisiran。”
待监管部门批准后,Alnylam将在美国,加拿大和西欧推广patisiran,而Sanofi Genzyme将在世界其他地方对该药物进行推广。我们期待这款新药能够早日获得批准上市,为患有这种恶性疾病的患者尽早带来首款RNAi疗法,帮助他们康复。
据大通福克斯美国会诊中心(CMAA)了解:Alnylam Pharmaceuticals公司今天宣布,FDA为针对运甲状腺素蛋白(TTR)的在研RNAi疗法patisiran颁发了突破性疗法认定(BTD),用于治疗成人有多发性神经病变的遗传性运甲状腺素蛋白介导的ATTR淀粉样变性(hATTR淀粉样变性)。相关最新的资讯信息,大通福克斯美国会诊中心(CMAA)将持续为您报道。
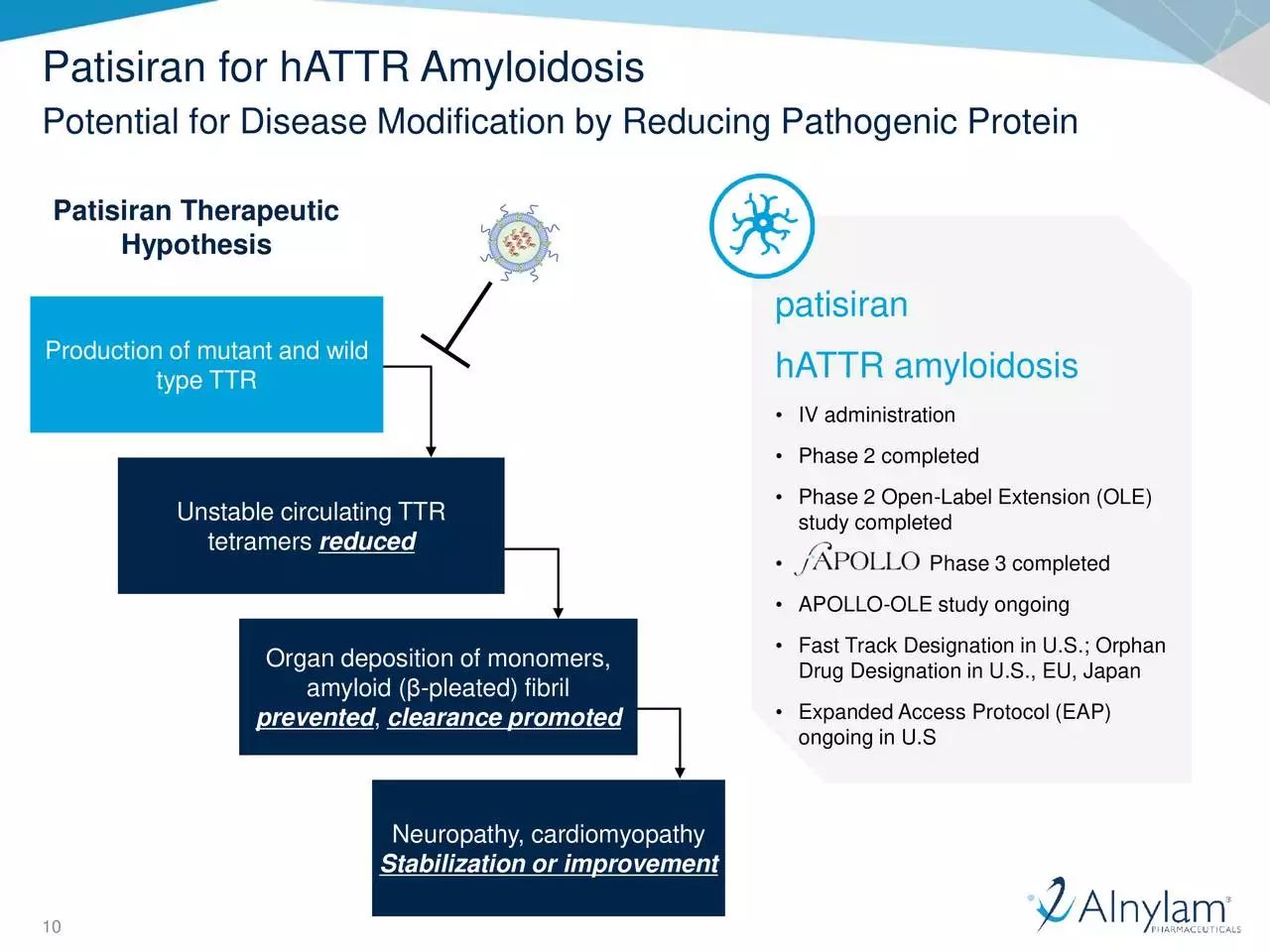
▲Patisiran的作用机理
突破性疗法认定旨在加速开发和审查用于治疗严重或危及生命疾病的药物,该药物与现有疗法相比,临床证据显示可显著改善重要临床终点。
Patisiran利用身体的天然机制,降低引起TTR淀粉样变的TTR蛋白的水平。它可以靶向和沉默特定信使RNA,阻碍TTR蛋白生成。可有助于清除周围组织的TTR淀粉样蛋白沉积,并恢复这些组织的功能。
APOLLO 是一项随机,双盲,安慰剂对照的全球性3期临床试验,旨在评估patisiran在多发性神经病变的hATTR淀粉样变患者中的疗效和安全性。这项研究的主要终点是在18个月期间内,225名患者修正神经病变损害评分(mNIS+7)从基线的变化。在18个月期间内,与安慰剂组相比,mNIS+7从基线明显降低(p小于0.00001),生活质量明显改善(p小于0.00001)。Patisiran治疗组与安慰剂组相比,mNIS+7损伤评分和生命质量评分的平均值和中位数变化均达到负值,说明在大部分患者和总体患者中都得到改善。5个其他次要终点与安慰剂相比还显示了显著的差异(p小于0.001)。Patisiran的总体安全性良好。Patisiran组和安慰剂组有类似比例的不良事件(AEs)(分别为96.6%和97.4%)和严重不良事件(SAEs)(分别为36.5%和40.3%)。
Alnylam已经启动了patisiran的滚动新药申请(NDA),并预计在2017年底进行最后一次提交。Patisiran已在美国获得了快速通道认定,并在最近获得了欧洲药品管理局的加速评估。Alnylam与Sanofi Genzyme结盟,计划年底前在欧盟提交营销授权申请。
“hATTR淀粉样变性是一种侵袭性,进展迅速,使人衰弱的致命疾病,对治疗方案的需求迫在眉睫。APOLLO 3期临床研究的有力证据表明,在研patisiran疗法有潜力改变hATTR淀粉样变性患者的生命,”TTR项目副总裁兼总经理Eric Green先生说:“突破性疗法认定使我们能够与FDA密切合作审查新药申请,尽快为患有这种令人痛苦的疾病患者带来patisiran。”
待监管部门批准后,Alnylam将在美国,加拿大和西欧推广patisiran,而Sanofi Genzyme将在世界其他地方对该药物进行推广。我们期待这款新药能够早日获得批准上市,为患有这种恶性疾病的患者尽早带来首款RNAi疗法,帮助他们康复。
参考资料:
[1] Alnylam Gets VIP Status as the FDA Slaps Breakthrough Tag on Patisiran
[2] U.S. Food and Drug Administration (FDA) Grants Alnylam Breakthrough Therapy Designation (BTD) for Patisiran for the Treatment of Hereditary ATTR (hATTR) Amyloidosis with Polyneuropathy
▌ 推荐阅读
CMAA报道 | 美国FDA批准治疗哮喘的新药上市了



